为推进《医疗器械临床试验质量管理规范》和《医疗器械临床试验机构条件和备案管理办法》,规范医疗器械临床试验过程,核查临床试验数据的真实性及合规性,湖北省药品监督管理局决定抽取部分已在我局备案的医疗器械临床试验项目进行现场检查。现将有关事项通告如下:
一、检查范围
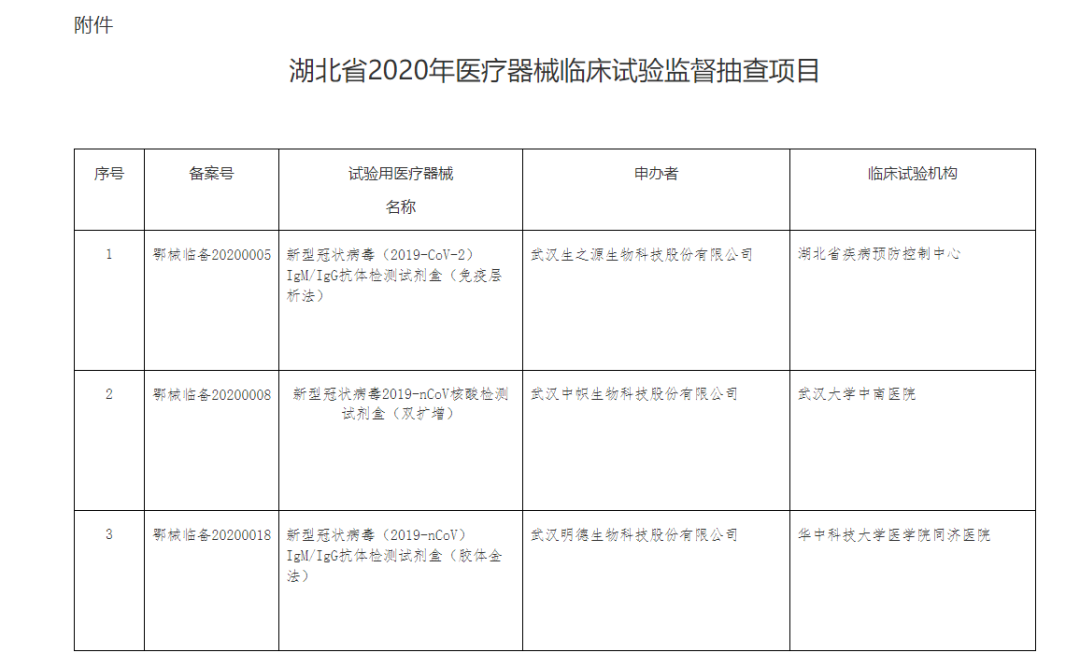
检查包括在我省进行医疗器械临床试验备案的第二类、第三类医疗器械临床试验的回顾性检查和过程性检查。综合考虑疫情防控需要,重点抽查新型冠状病毒2019-nCoV核酸检测试剂盒和抗体检测试剂盒,结合企业申报情况,现抽取3个临床试验项目(详见附件)开展现场检查。
二、检查依据
《医疗器械监督管理条例》(国务院令第680号)以及《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《医疗器械临床试验质量管理规范》(食品药品监管总局令第25号)、《国家药监局综合司关于印发医疗器械临床试验检查要点及判定原则的通知》(药监综械注〔2018〕45号)等规章和规范性文件。
三、检查程序
医疗器械临床试验监督检查工作由省局安排,检查组由注册管理处、医疗器械化妆品监管处、技术审评核查中心抽组人员组成,按照相关规定开展现场检查。现场检查实施前,将提前通知相应的临床试验机构、注册申请人。
四、检查结果处理
根据检查过程中发现的问题,检查结果依据《国家药监局医疗器械临床试验检查要点及判定原则的通知》(药监综械注[2018]45号)要求进行判定。对存在真实性问题的,依据《中华人民共和国行政许可法》《医疗器械监督管理条例》等相关规定进行处理。
特此通告。
附件:湖北省2020年医疗器械临床试验监督抽查项目
湖北省药品监督管理局
2020年12月7日
附件:
来源:湖北省药监局



